Les échinococcoses, des maladies parasitaires en expansion


Depuis quelques années, les ceintures et autres coulées vertes envahissent les villes et leurs abords, ramenant de la biodiversité dans des lieux où elle avait longtemps été négligée, voire combattue. S’il est agréable de vivre dans un tel environnement, et de le partager avec nos compagnons domestiques et des animaux sauvages, il faut avoir conscience que cela signifie aussi accepter de côtoyer les microbes dont ces derniers sont les hôtes.
Or, la gamme d’organismes pathogènes qu’ils hébergent est très large, et certains sont susceptibles de passer à l’être humain, provoquant des maladies appelées zoonoses. L’une des plus célèbres est la maladie de Lyme, causée par une bactérie et propagée par les tiques. Mais d’autres zoonoses, beaucoup plus rares, sont moins connues. Elles n’en sont pas moins graves.
C’est le cas des échinococcoses provoquées par les échinocoques, des vers plats parasites qui peuvent être propagés par les renards, certains rongeurs, voire nos chiens et chats domestiques. De quoi s’agit-il exactement, et comment s’en protéger ?
De la famille des ténias
Les échinocoques appartiennent à la famille des Cestodes, des vers plats parasites dont les représentants les plus connus sont probablement les ténias. On dénombre aujourd’hui huit espèces d’échinocoques dans le monde, dont la dernière, Echinococcus shiquicus, n’a été découverte qu’en 2005 sur le plateau tibétain.
L’espèce la plus répandue est l’échinocoque granuleux (Echinococcus granulosus), que l’on trouve sous toutes les latitudes et sur tous les continents. Après avoir émergé au Moyen-Orient, au moment de la domestication du mouton, voici 10 000 à 12 000 ans, cet échinocoque s’est propagé au rythme de l’expansion du bétail domestique. Son arrivée en Australie et en Nouvelle-Zélande coïncide par exemple avec l’introduction du mouton (suite à la colonisation anglaise), tandis qu’il a conquis l’Amérique en même temps que les Européens et leur bétail.
En Europe arctique et tempérée, donc en France, c’est une autre espèce qui occupe majoritairement le terrain : l’échinocoque multiloculaire (Echinococcus multilocularis). Absent du bassin méditerranéen, on le trouve de l’Oural au Cotentin et de la Scandinavie au sud des Alpes.
Sa différenciation se serait produite aux alentours du détroit de Behring, voici moins de 2,6 millions d’années selon certains travaux. Profitant de retraits glaciaires, il aurait conquis la Sibérie, le plateau tibétain et l’Amérique du Nord, puis l’Europe, au Pléistocène tardif. Beaucoup plus récemment, au XXe siècle, il a accompagné l’introduction sur l’île japonaise d’Hokkaido de renards destinés à lutter contre les campagnols destructeurs de prairies.
Comme de nombreux autres parasites, les échinocoques ont coévolué avec les espèces animales qu’ils infectent, lesquelles vivent au sein des mêmes écosystèmes qu’eux. Ils ont notamment acquis l’aptitude de passer d’un hôte à l’autre par succession générationnelle, en mettant à profit la prédation. Autrement dit, chaque étape de leur développement – de l’œuf à l’adulte en état de se reproduire – se déroule dans un animal différent.
Une reproduction complexe
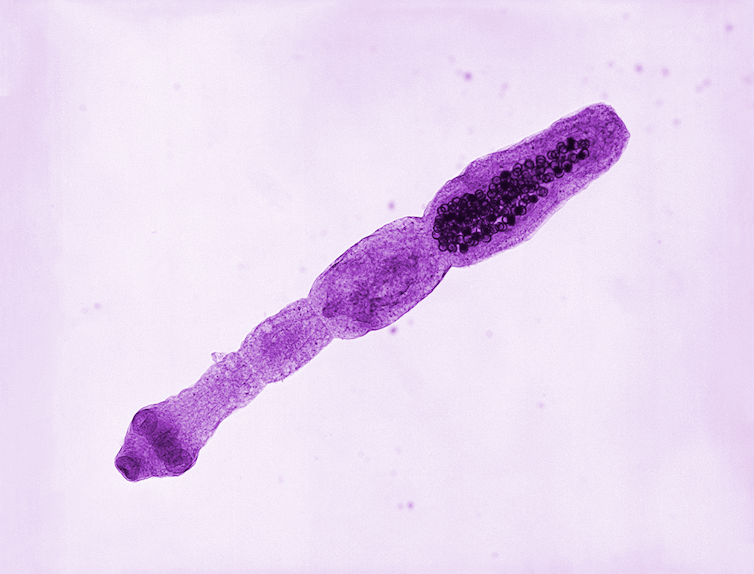
Les échinocoques adultes mesurent quelques millimètres. Ils vivent et se reproduisent dans l’intestin de leur hôte dit « définitif », qui est toujours un carnivore : chien, renard, etc. Leurs œufs, répandus dans l’environnement via les crottes de ce dernier, peuvent être accidentellement ingérés par un autre hôte, dit « intermédiaire », qui diffère selon les espèces d’échinocoque : des ongulés pour l’échinocoque granuleux (souvent le mouton), plus généralement un campagnol pour l’échinocoque alvéolaire.
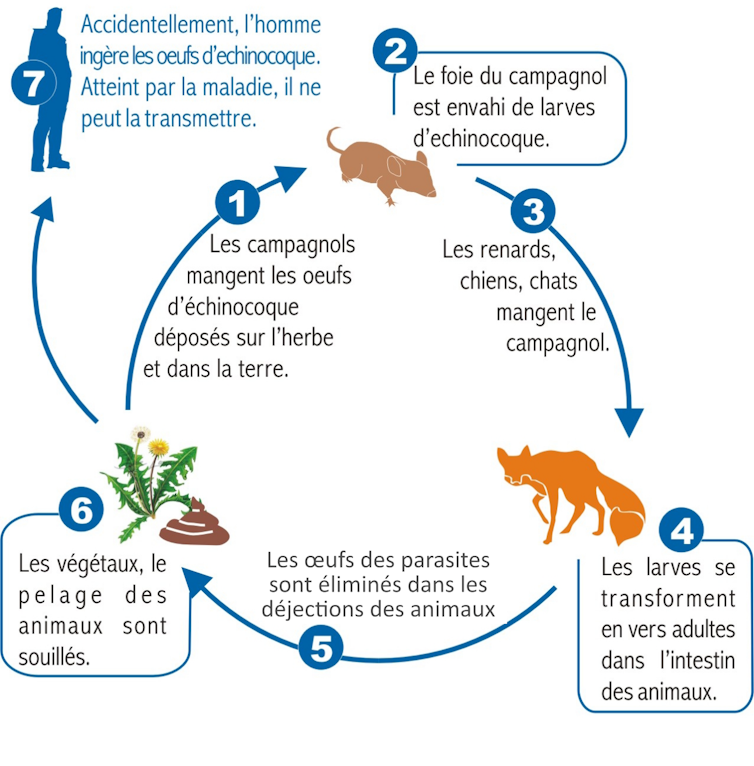
Les embryons sortent alors des œufs, migrent dans ce nouvel hôte, et finissent par se loger dans son foie ou ses poumons voire, quoique moins souvent, dans d’autres organes. Cerveau, œil, peau, muscle, os, tube digestif, pancréas, reins, rate… Tous les cas ont été décrits ! Ils y forment alors un tissu larvaire, qui se présente comme une tumeur : pouvant mesurer d’un à plusieurs dizaines de centimètres de diamètre, cette structure est constituée d’un mélange de tissu parasitaire et de tissus inflammatoires de l’hôte. Comme on l’imagine, les symptômes varient selon l’organe touché…
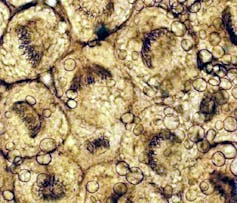
Lors de la troisième étape du développement, ce tissu parasitaire produit des milliers de précurseurs des vers adultes (les « protoscolex ») capables de vivre dans les hôtes définitifs, prédateurs. Lorsque l’un des carnivores concernés consomme une proie contaminée par les protoscolex, il se retrouve infecté à son tour. Les parasites se transforment alors en milliers d’adultes dans la muqueuse de son intestin, prêts à se reproduire et à pondre des œufs, commençant ainsi un nouveau cycle.
L’être humain n’est pas un hôte habituel du parasite, mais il arrive malgré tout qu’il se retrouve contaminé, ce qui a de lourdes conséquences.
Comment se contamine-t-on ?
L’infection de l’être humain résulte de l’ingestion d’œufs du parasite. Ceux-ci peuvent être présents dans des aliments, l’eau ou des sols, ou sur le pelage des hôtes définitifs (renards, chiens ou chat).
La personne contaminée constitue un hôte dit « accidentel » : en effet, elle ne participe pas au cycle du parasite, puisque celui-ci ne peut pas rejoindre son hôte définitif, chien ou renard, l’humain n’en étant pas la proie.
On distingue deux maladies différentes, en fonction de l’échinocoque impliqué : l’échinococcose dite « kystique », causée par l’échinocoque granuleux, et l’échinococcose alvéolaire, dont est responsable l’échinocoque multiloculaire. Cette dernière forme, la plus grave, est celle qui sévit majoritairement en France.
Le plus souvent, notre système immunitaire est capable d’éliminer les vers ingérés. Cependant, il échoue parfois (environ 1 fois sur 100 pour l’échinocoque alvéolaire). Dans ce cas, le parasite s’installe dans l’organisme du malade, causant de graves dégâts.
Deux maladies graves
Le premier cas d’échinococcose alvéolaire a été identifié et décrit chez un patient en Allemagne en 1852. Elle doit son nom au fait que le tissu parasitaire, dans l’organisme de l’hôte intermédiaire, produit des dizaines, voire de centaines de microkystes (qui constituent autant d’« alvéoles »). Y sont associées des cellules de la réponse immunitaire et des tissus fibrosés ou nécrosés, dont la présence témoigne du succès partiel du système immunitaire à repousser l’envahisseur.
Mortelle pour l’être humain, cette maladie évolue le plus souvent silencieusement, parfois pendant 10 ans, voire plus. Durant cette période, le tissu parasitaire prolifère dans le foie, sous forme d’un « pseudo-cancer ». Au stade avancé, les symptômes les plus fréquents sont des douleurs abdominales et une jaunisse, accompagnée ou non de fièvre, en relation avec l’obstruction des voies biliaires. La maladie est fréquemment découverte « par hasard », au cours d’une échographie ou d’un scanner du foie (la localisation hépatique est très prédominante).
Sans traitement, le pronostic est aussi sombre que celui d’un cancer hépatique auquel ressemble l’échinococcose alvéolaire. Soulignons toutefois qu’au cours des 40 dernières années, les progrès de la chirurgie hépatique et de la prise en charge à long terme des patients (prise d’un antiparasitaire, l’albendazole notamment), ont amélioré considérablement les chances de survie.
L’échinocoque granuleux provoque quant à lui une autre maladie grave, l’échinococcose kystique, qui peut elle aussi évoluer silencieusement durant plusieurs années.
Décrite dès l’Antiquité par plusieurs médecins, dont Hippocrate, elle se traduit par des kystes bien délimités, qui ne font généralement parler d’eux que lorsqu’ils compriment les vaisseaux (dans tous les organes), les voies biliaires (dans le foie, avec une jaunisse), les bronches (dans les poumons, avec des troubles respiratoires), ou les centres nerveux (dans le cerveau, avec des signes neurologiques variés : paralysies, épilepsie…). Ces kystes peuvent aussi se rompre, à l’occasion d’une chute, d’un accident de sport, ce qui peut être à l’origine d’un choc allergique grave, de complications infectieuses ou d’une dissémination des kystes, dans la cavité abdominale, par exemple.
La prise en charge des patients dont les symptômes, variés, dépendent de la localisation du parasite, consiste selon les cas, à procéder à l’ablation chirurgicale du kyste, ou à en aspirer le contenu avant de détruire chimiquement sa paroi. Elle peut aussi se faire par administration d’un médicament antiparasitaire (antihelminthique) tel que l’albendazole.
Un parasite en expansion
Chaque année, de 200 à 300 millions de personnes sont infectées par des échinocoques dans le monde. En France, le nombre de nouveaux cas humains d’échinococcose alvéolaire a triplé depuis les années 1990 pour atteindre 35 cas par an, en moyenne, au cours des dix dernières années. Les cas autochtones d’échinococcose kystique sont encore plus rares (8 au total depuis 2016).
Il faut donc garder en tête que, même dans les zones historiques d’endémie (longtemps les régions montagneuses du centre et de l’est du pays), le risque de contracter une échinococcose alvéolaire est des centaines de fois plus faible que de mourir dans un accident de la route, des méfaits du tabac ou de la malbouffe !
En Europe, la distribution principale de l’échinococcose alvéolaire se limitait historiquement aux zones montagneuses : Nord de l’arc alpin, Jura, Vosges, Massif central, etc. On observe cependant depuis les années 1990 une extension de cette aire vers l’ouest de la France, ainsi que vers le nord, jusqu’en Suède, où elle était inconnue jusqu’en 2011.
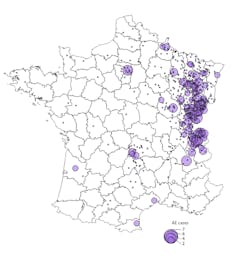
Cette colonisation est concomitante de l’augmentation générale des populations de renards suite à l’élimination de la rage sylvatique, au début des années 1980. En Europe, la circulation de l’échinocoque alvéolaire dépend en effet d’un cycle entièrement « sauvage », qui implique principalement le renard roux et potentiellement la plupart des espèces de rongeurs (campagnols, rats musqués, etc.).
Dans les faits, ce sont principalement le campagnol terrestre et le campagnol des champs, qui concentrent le flux parasitaire, en raison de la relative spécialisation alimentaire des renards sur les campagnols des prairies quand ces derniers abondent. On sait aujourd’hui que la dynamique des populations de ces rongeurs dépend de la composition et de la structure du paysage. Classiquement, les paysages homogènes dominés par de larges prairies permanentes sont ceux où les densités de campagnols des prairies sont périodiquement les plus élevées. Ce sont aussi ceux qui comptent la plus grande fréquence de renards infectés et le plus grand nombre de cas humains d’échinococcoses alvéolaire.
L’intensité de la transmission du parasite dépend donc indirectement d’un paysage qui résulte lui-même de l’utilisation historique qu’en a faite l’être humain, sous contraintes économiques. Dans la plupart des régions, le nombre de renards est proche de la capacité d’accueil normale des écosystèmes. Elle fluctue autour de cette valeur du fait d’épidémies locales de gale sarcoptique et de maladie de Carré. Certaines populations de renards se sont également urbanisées, portant dans de nouveaux espaces le parasite, essentiellement rural à l’origine.
L’infection des chiens et des chats, qui consomment des rongeurs porteurs du parasite, peut aussi faciliter l’infection humaine. Si ce cas de figure est moins fréquent en Europe que celui impliquant le renard, il n’en représente pas moins un danger réel pour le propriétaire, sa famille et ses voisins, par la concentration de crottes infectantes qu’elle occasionne à proximité des habitations et dans les jardins.
Dans le monde, cette « domestication » du cycle de l’échinocoque alvéolaire est d’ailleurs la principale raison de sa fréquence élevée dans certaines populations, comme en Chine de l’Ouest.
Les dynamiques de l’échinocoque alvéolaire observées sur d’autres continents, bien qu’obéissant aux mêmes règles générales, peuvent se révéler très différentes du fait de la variété des communautés d’hôtes, des comportements humains, et peut-être du patrimoine génétique du parasite.
En Amérique du Nord continentale, l’écologie de sa transmission commence seulement à être déchiffrée, alors que le nombre de cas humains détectés, très faible jusqu’au début du siècle, semble s’accroitre au Canada par exemple.
Comment se prémunir de cette maladie ?
Diminuer la densité des hôtes intermédiaires aux échelles régionales appropriées est irréaliste, car cela supposerait de bouleverser complètement le paysage et les systèmes de production agricole, avec des conséquences économiques et écologiques considérables sur les autres espèces. Il en est de même pour les hôtes définitifs.
De 2008 à 2012, une expérimentation a été conduite dans les environs de Nancy pour mesurer l’effet d’une diminution de la population de renards. Malgré un effort de prélèvement conséquent, non seulement la population de renards n’a pas été réduite, mais la prévalence de l’échinocoque multiloculaire a augmenté de 40 % à 55 %, alors qu’elle restait stable dans la zone témoin adjacente.
Devant l’impossibilité d’éliminer le parasite et ses hôtes, il convient donc plutôt de se résoudre à « vivre avec ». La meilleure des préventions consiste à engager les personnes à ne pas manipuler de renards, et à vermifuger régulièrement (tous les mois et demi) leurs chiens et chats avec un vermifuge adapté (praziquantel).
Sachant que les œufs de l’échinocoque alvéolaire ne résistent pas à la chaleur, la consommation de végétaux cuits met à l’abri de toute contamination. Lors de la cueillette, veiller à ne ramasser que les fruits poussant à une hauteur de quelques dizaines de centimètres est un bon moyen d’être certain qu’ils n’auront pas été souillés par une crotte de carnivore.
Clôturer les jardins pour éviter leur fréquentation par les renards ou les chiens et chats est également efficace, comme l’a montré une étude conduite dans 192 jardins potagers ruraux et 71 jardins potagers urbains menée dans l’est de la France.
Des moyens prophylactiques supplémentaires peuvent même être appliqués localement si nécessaire, comme la vermifugation des renards fréquentant les abords des habitations par des appâts au praziquantel. Cette approche présente l’avantage de ne pas déstabiliser la population et donc de ne pas laisser la place vide pour de nouveaux arrivants infectés.
Les récentes pandémies qui ont affecté et affectent encore l’Europe comme le reste du monde ont mis en évidence les interconnexions qui existent entre la santé humaine, celle des animaux et l’état écologique global, conceptualisées par l’approche « One Health » (« Une seule santé »).
Les échinocoques révèlent eux aussi à quel point le fonctionnement des socioécosystèmes est déterminant dans la propagation des infections. Il faudra apprendre à vivre avec eux, tout en limitant les conditions de leurs émergences par une prévention élargie.
Patrick Giraudoux, Professeur émérite d’écologie, Université de Franche-Comté – UBFC; Dominique Vuitton, , Université de Franche-Comté – UBFC et Jenny Knapp, Ingénieur de Recherche, Université de Franche-Comté – UBFC
Cet article est republié à partir de The Conversation sous licence Creative Commons. Lire l’article original.